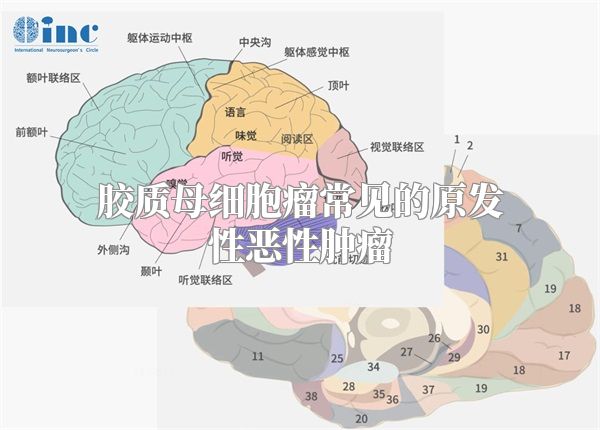
胶质瘤侵袭中发育调控的信号通路
胶质母细胞瘤(GBM世界卫生组织四级胶质瘤)是成人中最具侵袭性、浸润性和致死性的脑肿瘤。这些恶性肿瘤目前是不可治愈的,因为它们的侵袭性和对传统疗法的耐药性。尽管对GBMs的生物学进行了广泛的分子和基因分析,但遵循护理治疗标准的患者结果仍然令人沮丧,中位生存期仅为1214个月。GBM治疗中最大的挑战之一是高侵袭性肿瘤细胞的存在,这些细胞扩散到正常的脑实质中。这些侵袭性细胞逃避手术切除,抵抗针对增殖细胞的常规治疗,并且是肿瘤复发的主要原因。大多数复发性GBM表现出对放射和替莫唑胺的耐受性,这两种药物都是GBM患者术后的一线治疗药物。据报道,GBMs在复发时经常改变其生物学特征。例如,Halliday等人利用一种确定的前神经节GBM亚型的鼠模型,证明了辐射导致向具有间充质特性的肿瘤转移。类似地,已被批准用于复发性GBMs的抗血管生成疗法(阿瓦斯丁/贝伐单抗)也显示出产生侵袭性和高度浸润性肿瘤。由于几乎所有的GBM患者都经历复发,因此迫切需要有效的临床治疗来治疗这种恶性肿瘤。

几项针对大脑中特定细胞群的遗传学研究表明,GBM的起源细胞很可能是神经干细胞或停滞祖细胞。这些研究还强调了正常神经发育和胶质细胞瘤之间的相似之处。在正常的大脑发育过程中,神经干细胞中时空调节的信号转导通路确保了足够数量的祖细胞的产生及其随后的分化。500多个GBM肿瘤的大规模遗传学研究神经胶质瘤细胞的单细胞RNA测序表明GBM细胞利用这些相同的信号网络来促进肿瘤生长和侵袭。
与其他恶性肿瘤不同,GBM细胞很少转移到身体的其他器官。在GBM中,胶质瘤细胞通过两种类型的细胞外空间迁移:构成白质束以及神经元和胶质细胞之间间隙的脑实质,以及围绕血管壁的血管周围空间。为了确保肿瘤扩散到周围健康的脑组织中,位于侵袭前沿的胶质瘤细胞必须经历几个复杂的生化和形态学变化。这种过程需要从肿瘤块中分离,获得高度迁移的表型,与脑细胞外基质的多种蛋白质组分(糖胺聚糖、层粘连蛋白、纤连蛋白、tenascin、巢蛋白、原纤维胶原和弹性蛋白的复杂混合物)相互作用以及降解。虽然细胞外基质显然是胶质瘤细胞必须通过的一个物理屏障,以建立非描绘的入侵途径,但它也提供了合适的配体(如整合素、tenascin C),胶质瘤细胞可以暂时利用这些配体作为锚,将自己向前拉。因此,除了与细胞外基质建立有利的物理相互作用外,入侵的神经胶质瘤细胞还必须能够化学重塑脑细胞外基质的整体结构和组成,以允许肿瘤广泛生长。
在大多数实体癌(包括GBM)的前沿,由侵入肿瘤细胞中表达的蛋白酶和/或蛋白酶激活剂介导的复杂蛋白水解事件在引导细胞通过细胞外基质迁移中起着重要作用。事实上,许多研究报告了神经胶质瘤细胞过度表达许多降解细胞外基质的蛋白酶,包括各种基质金属蛋白酶(MMP、MMP2、MMP9、MMP13)、金属内肽酶(ADAMs)、半胱氨酸蛋白酶(组织蛋白酶B、L、S)、天冬氨酸蛋白酶(组织蛋白酶D)和丝氨酸蛋白酶(尿激酶型纤溶酶原激活剂)。由于广泛的细胞外基质重塑是肿瘤细胞侵袭的必要步骤,因此我们在本综述中提到的相同信号通路(WNT、PI3K、MAPK、HGF/cMET、TGFβ)也被发现显著上调恶性胶质瘤中无数蛋白水解酶的表达也就不足为奇了。关于神经胶质瘤细胞如何积极利用所有这些蛋白酶家族来促进快速侵入脑实质的更详细的讨论。
透明质酸(透明质酸),一种调节细胞粘附和迁移的糖胺聚糖,也与提供促进侵袭性胶质瘤细胞通过周围细胞外基质浸润的微环境线索有关。重要的是,发现与远处的正常脑组织相比,透明质酸在肿瘤周围区域更丰富。Lim等人最近的一项研究表明,肿瘤相关的间充质干细胞样细胞——与胶质瘤细胞相互作用的基质细胞——可能通过诱导透明质酸合酶2而在肿瘤微环境中产生大量透明质酸。除了提供机械支持外,透明质酸还与多种同源受体相互作用,包括CD44、透明质酸介导的运动性受体(RHAMM)和细胞间粘附分子1 (ICAM1),其高表达与GBM患者预后差有关。透明质酸与CD44和表皮生长因子受体调节剂之间的相互作用已被证明导致细胞内信号级联的激活,从而增强自我更新和肿瘤细胞侵袭。
GBMs治疗中的挑战之一是肿瘤复发和对当前疗法的耐药性。强有力的证据表明,GBM肿瘤具有正常中枢神经系统发育的劫持特征,其中GSC是肿瘤生长的主要嫌疑人和驱动力。在发育过程中,时空调控的信号通路控制着神经干细胞的增殖、分化和迁移。同样的信号通路被干细胞用来确保肿瘤的生长和扩散。尽管对研究神经胶质瘤侵袭所涉及的信号通路越来越感兴趣,但还需要进一步的研究来确定干细胞和微环境在促进侵袭中的作用。未来的研究集中在阐明干细胞和肿瘤微环境之间的复杂相互作用,这将有助于阐明可用于GBM治疗的信号通路和关键分子。
- 本文“胶质瘤侵袭中发育调控的信号通路”禁止转载,如需转载请注明来源及链接(https://www.jiaozhiliu.org.cn/show-261.html)。
- 更新时间:2020-12-01 15:20:55




 关注微信公众号
关注微信公众号